Spettroscopia Chimica
È noto che molte sostanze portate sulla fiamma hanno la proprietà di produrre nello spettro alcune righe luminose. Possiamo fondare su queste righe un metodo di analisi quantitativa che allarga ampiamente il campo delle reazioni chimiche e porta alla soluzione di problemi finora irrisolti...
Così scrivevano Kirchhoff e Bunsen nel loro articolo Analisi Chimica per mezzo di Osservazioni Spettrali del 1860. Ma chi erano Bunsen e Kirchhoff?
A Breslavia nel 1851, il chimico Robert Bunsen e il fisico Gustav Kirchhoff fecero amicizia.
Il professor Bunsen, a quarant'anni, aveva già svolto una serie di importanti lavori, in particolare su un composto dell'arsenico, il cacodile, che non solo è tossico ma prende fuoco spontaneamente nell'aria! Bunsen aveva perso un occhio in una di queste esplosioni. Egli aveva anche scoperto un antidoto per il cianuro (rischiando di morire avvelenato).
Kirchhoff era un brillante giovane esercitatore (aveva 27 anni), e da studente aveva enunciato le sue leggi sulle correnti elettriche. Anch'egli sarebbe stato colpito da una disabilità, in quanto in seguito a una caduta fu costretto a vivere metà della sua vita con stampelle o sedia a rotelle, conservando “il suo temperamento lieto e amabile”.
Nel 1854 Bunsen diventò professore a Heidelberg, e convinse Kirchhoff a venire a insegnare lì. I due insegnarono e lavorarono per vent'anni, e fecero la loro grande scoperta.
Bunsen, abbandonate le sostanze pericolose, escogitava tecniche per separare, identificare e misurare le sostanze chimiche. Perciò costruiva diversi strumenti originali.
Aveva costruito batterie per isolare quantità di metalli puri con l'elettrolisi (la batteria Bunsen, con un elettrodo in carbone). Aveva costruito il bruciatore Bunsen (o “becco Bunsen”) per i test alla fiamma, e produceva una fiamma molto calda e poco luminosa che non interferiva coi colori delle sostanze.
Nell'estate del 1859 Kirchhoff suggerì analizzare i colori con un prisma, o con un altro strumento opportuno. Ad ottobre il loro prototipo era pronto. Lo spettroscopio di Bunsen e Kirchhoff. Combinava due telescopi, un prisma e un becco Bunsen.
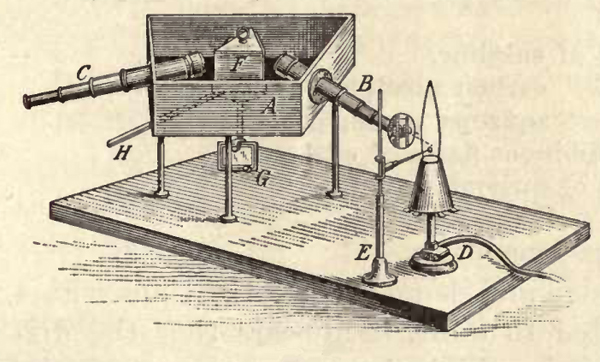
In figura è rappresentato l'apparato che abbiamo usato per l'osservazione degli spettri. A è una scatola annerita all'interno col fondo a forma di trapezio e poggia su tre piedi; i lati inclinati formano un angolo di circa 58° e sostengono due telescopi B e C. L'oculare del primo è rimosso e sostituito da una lamina in cui è formata una fenditura... la lampada D è sistemata davanti alla fenditura... un filo di platino molto sottile che forma un piccolo uncino è sostenuto da E... tra gli obiettivi dei telescopi B e C è posto un prisma che può ruotare... ruotando il prisma lo spettro della fiamma si possono osservare le diverse porzioni dello spettro...
Ci sono molti modi di costruire spettroscopi con materiali semplici, usando i CD o i DVD al posto del prisma, con tubi e scatole di cartone. I CD che scompongono la luce si possono usare in riflessione ma anche in trasmissione, strappando la patina metallizzata con lo scotch da pacchi.
Si può realizzare una fiamma non luminosa con alcune gocce di alcol su un vetrino.

Bunsen e Kirchhoff cominciarono a osservare le righe dei metalli alcalini e alcalino-terrosi. Per ogni elemento purificavano e introducevano nella fiamma diverse sostanze e composti. Per esempio, per il sodio: sodio metallico, cloruro di sodio, bromuro di sodio, idrossido di sodio, solfato di sodio... introducendoli in fiamme diverse: fiamma di alcol, di idrogeno, di gas naturale...
Da queste indagini comprensive e laboriose, risulta che la differenza nelle combinazioni dei metalli, la molteplicità dei processi chimici nelle diverse fiamme e l'enorme differenza di temperature di esse, non hanno alcuna influenza sulla posizione delle righe spettrali corrispondenti ai metalli individuali.
Appare dunque al di là di ogni dubbio che le righe luminose di uno spettro possano essere considerate come prova certa della presenza del metallo in considerazione. Esse possono servire come mezzo per individuare questo materiale più certamente, più rapidamente e con minori quantità di ogni altro metodo analitico.
Bunsen e Kirchhoff lanciarono così diverse linee di ricerca:
1. l'analisi di minutissime quantità
In un angolo della stanza di circa 60 metri cubi essi vaporizzarono 3 mg di clorato di sodio, mentre la fiamma non luminosa era accesa davanti allo spettroscopio nell'altro angolo della stanza. Dopo alcuni minuti la fiamma, gradualmente coloratasi di giallo pallido, dava una forte riga del sodio, che svanì dopo circa 10 minuti... essi calcolarono che potevano distinguere 1/3 di un miliardesimo di grammo.
Da una tale sensibilità di reazione è evidente che solo raramente una reazione del sodio non è visibile nell'atmosfera incandescente. La terra è coperta per più di due terzi della sua superficie da una soluzione di cloruro di sodio, che, quando le onde si rompono nella schiuma, è continuamente trasformata in spray...
2. la scoperta di nuovi elementi
Bunsen si accorse di una riga blu “non identificata” in un campione d'acqua minerale, e congetturò che fosse dovuta a un elemento allora sconosciuto. Distillando pazientemente quaranta tonnellate di quest'acqua minerale, riuscì a isolare 17 grammi di questo elemento, che chiamò cesio, ovvero, “profondo blu”. In questo modo, riconoscendo righe spettrali non identificate, furono scoperti altri 25 elementi, tra cui il fluoro, l'elio e il neon.
Le scoperte dei nuovi elementi (tra cui l'intera serie dei gas nobili) per via spettroscopica e la somiglianza degli spettri degli elementi dello stesso gruppo furono fattori importanti per affermare il sistema periodico di Mendeleev.
3. l'atmosfera del sole
Questo metodo apre alla ricerca chimica un campo, finora chiuso, che si estende oltre i limiti della terra a tutto il nostro sistema solare... poiché con questo metodo analitico è sufficiente vedere il gas in uno stato incandescente per analizzarlo, segue subito che si può fare la stessa cosa con l'atmosfera del sole e delle stelle più luminose.
Uno di noi [Kirchhoff] ha già provato, con considerazioni teoriche, che lo spettro di un gas incandescente viene invertito, ossia, che le righe luminose sono trasformate in righe nere, quando una sorgente di luce di intensità sufficiente, che dà uno spettro continuo, è posta dietro il gas incandescente.
Da ciò concludiamo che lo spettro del sole, con le sue righe scure, non è nient'altro che l'inversione dello spettro che l'atmosfera del sole mostrerebbe da sola. Perciò l'analisi chimica dell'atmosfera del sole richiede soltanto l'analisi di quelle sostanze che, quando portate in una fiamma, producono righe luminose che coincidono con le righe scure dello spettro solare.
Reinventando questi esperimenti con materiali semplici, si può usare lo spettroscopio per identificare i metalli che formano i vapori luminosi nelle lampade al neon, nelle lampade a basso consumo (mercurio), nei lampioni stradali (sodio e tracce di mercurio). Si possono osservare spettri continui, spettri a righe, e spettri di assorbimento.

4. la natura degli atomi
Le righe spettrali emesse dai gas incandescenti, e lo spettro continuo emesso dai corpi caldi, contenevano informazioni sulle proprietà e sulla struttura dei corpi a livello atomico.
Gli spettri a righe, che si vedono così bene anche con un CD e un tubo di cartone, avrebbero poi formato la base della fisica atomica.
E così, la ricerca combinata di un chimico e un fisico aprì nuovi orizzonti alla scienza del tempo, dalla tavola periodica di Mendeleev all'atomo di Bohr e oltre.
* * *
In conclusione, segnaliamo questo video, dal canale YouTube di Zanichelli Editore S.p.a., realizzato nell'ambito del progetto Laboratorio Semplice Bovolenta Reinventore (2012).




