I modellini nella didattica chimica 3: Linus Pauling e l´unione tra meccanica quantistica e chimica
In due articoli precedenti abbiamo visto come nella seconda metà dell'Ottocento i chimici dei diversi paesi del mondo fossero arrivati ad elaborare i ritratti delle molecole (qui); e come, nei primi trent'anni del Novecento, i fisici del dei diversi paesi del mondo fossero arrivati ad elaborare i ritratti degli atomi (qui).
C'erano naturalmente da ambo le parte tentativi di conciliare i diversi risultati, ma anche ostilità, di cui era un buon esempio il chimico americano Richard Tolman nel 1921.
“estrema ostilità verso i fisici con il loro atomo assurdo, come un pancake di elettroni roteanti... Quest'atomo costruito dai fisici, è come un sistema solare... in parte per la loro mancanza di familiarità con i fatti che riguardano il comportamento degli atomi nella combinazione chimica. Nessun chimico penserebbe mai all'atomo di carbonio come a un nucleo positivo con anelli di elettroni che ruotano intorno su un unico piano. L'atomo di carbonio deve avere proprietà tetraedriche, e io in generale sento che l'atomo cubico di Lewis e Langmuir rappresenta i fatti chimici meglio di qualunque cosa proposta dai fisici”.
Un esempio di segno opposto era il fisico Robert Millikan, che nel 1924 castigava i chimici americani perché
“si immaginano che gli elettroni stiano seduti intorno su belle scatoline di cartone, ad ogni angolo, pronti a stringere le mani o ad attaccarsi ad altri elettroni sfaccendati su altri atomi...” eccetera eccetera.
Del resto il modello dell'atomo dei fisici intendeva rendere conto dei dati della spettroscopia (gli spettri a righe), dell'attrazione e repulsione tra cariche elettriche, delle leggi del moto e della stabilità. Il modello dell'atomo dei chimici guardava innanzitutto alle molecole, a come spiegare il legame ionico e le molecole biatomiche, la valenza, la reattività delle molecole, le molecole organiche.
La figura di spicco della riconciliazione tra meccanica quantistica e chimica fu il chimico americano Linus Pauling (1901-1994), uno dei più importanti chimici del Novecento, con tre contributi di primissimo piano, tra i molti altri.
- la natura del legame chimico
- la struttura chimica delle proteine
- le malattie molecolari, come l'anemia falciforme

Nato a Condon (Portland) nell'Oregon, rimase orfano del padre (farmacista) a nove anni. La madre aprì una pensione e lui e la sorella la aiutavano facendo diversi lavori. Alle elementari la sua insegnante faceva esperimenti a lezione. A 13 anni Linus si innamorò della chimica, quando un suo compagno di giochi gli mostrò degli esperimenti. Esplosioni, acido solforico, very exciting. Si costruì un piccolo laboratorio in cantina, dove faceva gli esperimenti da un libro di Rufus Williams. Arrivò all'Università dell'Oregon già molto preparato e, dopo il primo anno, venne assunto come esercitatore nei corsi del primo anno.
Dopo la laurea in Oregon (ingegneria chimica, 1922) andò al Caltech in California, dove stava finendo la carriera il chimico Arthur Amos Noyes, grande insegnante che aveva giocato un ruolo importante nella crescita della chimica americana. Egli riconobbe il talento del giovane Pauling e ne curò la formazione facendolo studiare molti corsi specialistici e facendogli fare ricerca fin da subito. Impegnare gli studenti nella ricerca era uno dei chiodi fissi di Noyes come insegnante. Lo mandò per un anno di post-doc a Monaco all'Istituto del fisico Sommerfeld, 1926-27. Era al momento giusto nel posto giusto, negli anni in cui prendeva forma la meccanica quantistica.
Pauling si mise all'opera di gran lena e pubblicò tra il 1931 e il 1933 una serie di sette articoli su “La natura del legame chimico”, in cui esprimeva tutto il corpus di conoscenze dei chimici nel nuovo linguaggio della meccanica quantistica.
I suoi contributi toccarono la configurazione tetraedrica del carbonio e ottaedrica dei metalli di transizione ricavate dalla meccanica quantistica, la risonanza tra configurazioni molecolari, l'ibridizzazione degli orbitali, le regole per calcolare l'intensità dei legami come la valenza elettrostatica, una teoria dei momenti magnetici di molecole e ioni complessi...
Possiamo leggere qualche riga sul legame covalente dal suo libro di testo per i primi anni dell'Università.
gli atomi della maggior parte delle molecole sono tenuti insieme da un legame molto importante, il legame a coppia di elettroni condivisi o legame covalente... è il legame covalente che è stato rappresentato con una linea nelle formule scritte dai chimici per oltre un secolo...
la molecola più semplice è la molecola-ione di idrogeno, H2+, che consiste di due protoni e un elettrone. Le sue proprietà sono state determinate dallo studio dello spettro. I due protoni hanno una distanza media di 1.06 Å, e un'energia di legame di 255 kJ mol-1.
Il trattamento quanto-meccanico di H2+ da valori per la lunghezza e l'energia di legame in totale accordo con l'esperimento. L'elettrone è concentrato nella regione tra i due nuclei. La sua attrazione elettrostatica per i nuclei bilancia la repulsione mutua tra i nuclei, ed è la fonte dell'energia di legame. Il legame è detto legame a un elettrone...
Nella molecola di idrogeno H2 i due nuclei sono tenuti a una distanza di circa 0,74 Å; essi oscillano con un'ampiezza di pochi centesimi di Ångstrom a temperatura ambiente. I due elettroni si muovono molto rapidamente nella regione tra i due nuclei. Il moto dei due elettroni è in gran parte concentrato in quella regione. I due elettroni sono tenuti congiuntamente dai due nuclei e costituiscono il legame chimico tra i due atomi di idrogeno.
E così Pauling ci dà così anche un'idea molto pratica della molecola. I nuclei positivi si respingerebbero, ma tra loro ci sono gli elettroni negativi che li tengono stretti insieme. Due elettroni li avvicinano di più di un elettrone solo. E nel legame è contenuta dell'energia, come una molla compressa. I due nuclei oscillano intorno alla distanza di equilibrio, come se fossero ai capi di una molla.
Pauling amava molto i modellini di atomi e molecole. Quando Sommerfeld venne a tenere un corso al Caltech nel 1924, Pauling andò a presentargli un suo modellino della molecola d'acqua!
È conservata ancora oggi la collezione di modelli di atomi e molecole di Pauling, che trovarono la strada nelle sue lezioni, nei suoi libri, e lo aiutarono in alcune scoperte.

Dagli anni 30 Pauling lavorò molto sulla struttura di diverse grandi molecole, come le proteine, strutture composte da decine di migliaia di atomi. Studiò le proprietà magnetiche dell'emoglobina, il ruolo del legame a idrogeno, gli amminoacidi, fino alla scoperta (1950) della struttura secondaria delle proteine, con le cosiddette alfa-eliche e foglietti-beta.
È un aneddoto molto noto il fatto che egli arrivò alla struttura dell'alfa-elica arrotolando fogli di carta mentre era a letto con l'influenza, quasi giocando.
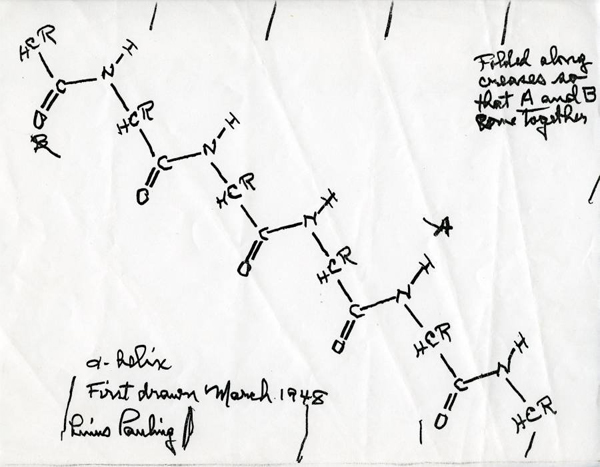
Nel suo istituto si costruivano molti modelli molecolari in legno e in gomma delle strutture studiate, l'ambiente ne era ricco. Era un po' come a Monaco da Sommerfeld, dove erano in mostra molti modelli dei cristalli e a Von Laue era venuta l'idea della diffrazione a raggi X per capirne la struttura. Ma in questo caso, i modelli erano le strutture macromolecolari.
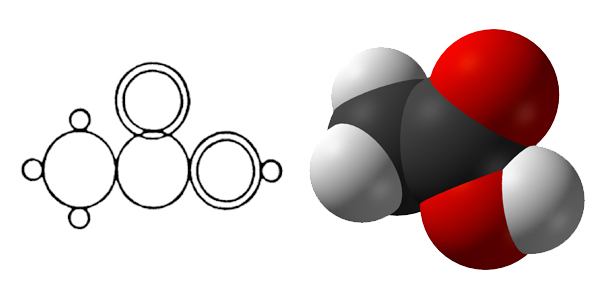
Nel 1956 Pauling descrisse questi modelli didattici in un articolo, insieme ai colleghi Corey e Koltun. Dalle loro iniziali questi modelli vengono talvolta detti CPK, ma sono noti anche come “SpaceFilling Models” o “modelli a calotta”. Vennero prodotti come kit per l'insegnamento.

Gli atomi sono rappresentati da sfere di diversi colori (praticamente gli stessi di Hofmann) che vengono troncate quando gli atomi si uniscono insieme per formare le molecole, un po' come quando si uniscono le bolle di sapone.
In un certo senso, i modelli “SpaceFilling” sono la visualizzazione concreta delle prime formule costituzionali di Loschmidt.
Dopo il Premio Nobel per la Chimica (1954), Linus Pauling vinse anche un Premio Nobel per la Pace (1962), per le sua attività in opposizione alla guerra atomica e il fall-out radioattivo nei test atmosferici.



