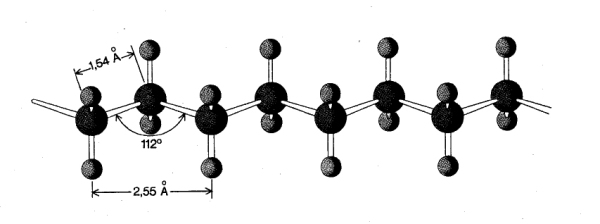
I modellini nella didattica chimica 1: I ritratti delle molecole
Con questo articolo iniziamo una piccola serie (saranno 4 articoli e alcuni video) per ripercorrere, in maniera necessariamente molto schematica, la strada che fisici e chimici hanno percorso per capire come sono fatti gli atomi e le molecole. Le “pietre miliari” su questa strada saranno i modelli usati per descrivere queste realtà microscopiche.
La nostra strada comincia negli anni sessanta dell'Ottocento. Fu una decade molto fertile per la chimica. Per esempio, nel 1860 ebbe luogo il Congresso di Karlsruhe sulla nomenclatura e i pesi atomici e molecolari, nel 1869 Mendeleev propose la sua Tavola degli Elementi.
In questi anni fecero la loro comparsa anche dei diagrammi e poi dei modelli per rappresentare le molecole delle diverse sostanze.
Il nome famoso nell'ambito della “teoria della struttura chimica” è quello del chimico tedesco August Kekulé, che propose la struttura ad anello del benzene, con legami semplici e doppi, risolvendo così uno dei grandi problemi della chimica del tempo. Tuttavia i contributi iniziali sono stati dati da scienziati meno famosi, e poi marginalizzati o dimenticati.
1858-1861 i diagrammi di Couper e Crum Brown
Lo scozzese Archibald Scott Couper aveva 27 anni quando presentò nel 1858 il suo saggio su “Una nuova teoria chimica”, ma la sua pubblicazione fu ritardata dal suo capo, Wurtz, e fu pubblicato invece un articolo di Kekulé, molto meno sviluppato, che ebbe così la priorità. Couper affrontò Wurtz che lo licenziò dal laboratorio, e Kekulé in lettera derise il suo articolo come poco chiaro e poco originale. Couper si ammalò e non si riprese più. Nel suo saggio aveva ampiamente usato formule di struttura con i simboli degli atomi collegati da linee, e il carbonio che entra in unione chimica con sé stesso.
Nel 1861 Alexander Crum Brown propose nella sua tesi di laurea “Sulla classificazione delle sostanze chimiche” una rappresentazione che completava, per così dire, quella di Couper, usando cerchi intorno ai simboli degli elementi, e linee per collegarli, comprese linee doppie per il legame doppio nell'etilene.
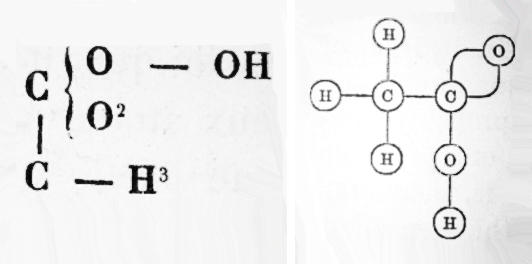
1861 le formule di Joseph Loschmidt
Lo scienziato e insegnante austriaco Joseph Loschmidt pubblicò nel 1861 un libro, “Studi Chimici” in cui presentò le sue costituzioni (o formule costituzionali) – formule della chimica organica in rappresentazione grafica. Si trattava dei disegni di 368 molecole organiche. Egli usava cerchi per rappresentare gli atomi, di diversa grandezza a seconda dell'atomo, con legami doppi e tripli, strutture ad anello, eccetera. Un lavoro impressionante, che non venne compreso dalla comunità dei chimici del tempo (Kekulé ironizzò anche su queste, chiamandole formule confusionali) e che fu riscoperto solo in seguito.
1865 i modellini “Ball & Stick” di Hofmann
Il chimico tedesco August Hofmann tenne nel 1865 a Londra una celebre lezione su “Il Potere Combinatorio degli Atomi”. Cominciò con una serie di esperimenti con una grande varietà di sostanze (facendo esplosioni, sbiancamento di colori, eccetera). Poi spiegò che i chimici del tempo stavano trovando la chiave per comprendere e classificare tutte le sostanze chimiche conosciute. Questa chiave, ovvero la teoria chimica della struttura, la illustrò con “il più piacevole dei giochi, il croquet”.
Le biglie da croquet rappresentino i nostri atomi, e si distinguano gli atomi dei diversi elementi dai diversi colori. Le biglie bianche sono atomi di idrogeno, le biglie verdi di cloro; gli atomi dell'ardente ossigeno rossi, quelli dell'azoto, blu; gli atomi di carbonio, infine sono rappresentati naturalmente con biglie nere. Ma noi dobbiamo, in più, mostrare il diverso potere combinatorio di questi atomi. Ciò lo otteniamo avvitando nelle biglie un numero di braccia metalliche (tubi e spilli), che corrispondono rispettivamente ai poteri combinatori degli atomi rappresentati, e che, mentre costituiscono un ulteriore aspetto distintivo, ci permettono di collegare le biglie e di erigere così una struttura meccanica che imita gli edifici atomici da illustrare. E così gli atomi di idrogeno e cloro, che sono atomi univalenti, hanno ciascuno un braccio, che rappresenta una unità di combinazione o attrazione; l'atomo di ossigeno, un atomo bivalente, avrà due braccia, che rappresentano due unità di attrazione; mentre gli atomi di azoto e carbonio, rispettivamente trivalente e quadrivalente, sono provvisti di tre e quattro braccia rispettivamente, che indicano le rispettive tre e quattro unità di combinazione di questi atomi.

E con questo sistema, Hofmann costruì una lunga serie di edifici molecolari, ognuno a rappresentare una delle sostanze che aveva presentato in precedenza, con gli esperimenti. Ogni sostanza, la sua molecola.

In questa lezione fecero la loro prima comparsa i modellini molecolari. Le reazioni nei loro confronti erano diverse.
Per alcuni il modellino molecolare era solo un costrutto matematico che riassumeva le caratteristiche della sostanza rappresentata. Per altri il modellino era un vero ritratto della molecola, e le posizioni delle biglie corrispondevano alla posizione degli atomi nella molecola. Per molti, comunque, erano un utile arnese euristico per scoprire e spiegare proprietà delle molecole.
I modellini pallina e bastoncino si prestavano naturalmente ad estensioni tridimensionali. L'idea era nell'aria.
Il chimico olandese Jacob Van't Hoff a 22 anni (1874) propose la struttura tetraedrica del carbonio tetravalente, predisse diverse strutture e le proprietà ottiche di alcuni composti organici.
Egli usava modellini con piccoli tetraedri di cartone. Ne propose anche la costruzione nel suo articolo “La Chimica nello Spazio” che venne pubblicato (e criticato) sulla rivista tedesca Giornale di Chimica Pratica.

I ritratti delle molecole “a pallina e bastoncino” sono da allora presenti, fino ad oggi, in moltissimi libri, articoli, videi, eccetera.
Per esempio, il premio Nobel per la chimica 1963, l'italiano Giulio Natta, li impiegò sia nelle lezioni e negli articoli specialistici sia nei libri divulgativi, come “Stereochimica – Molecole in 3D”.