I modellini nella didattica chimica 2: I ritratti dell´atomo
Ritratti dell'atomo
Sin dalla seconda metà dell'Ottocento quindi i chimici avevano composto i primi ritratti delle molecole, come piccole architetture di atomi (si veda il precedente articolo).
Alla fine dell'Ottocento i fisici affrontavano il loro problema, il ritratto dell'atomo.
1904 atomo di Thomson e atomo Saturniano
L'inglese JJ Thomson elaborò diversi modelli di atomo in seguito alla sua scoperta dell'elettrone e della sua carica negativa (1897).
L'idea generale era una sfera di carica positiva con incorporati migliaia di elettroni. Il gran numero di elettroni era dovuto al fatto che la loro massa è circa 1/1000 di quella dell'atomo, e Thomson congetturava che portassero tutta la massa loro. Questo modello venne chiamato “plum pudding” o “pan cake” model, in italiano “a panettone”, sebbene i canditi (gli elettroni) fossero rapidamente rotanti, e organizzati in anelli successivi. È questo un aspetto importante che spesso si trascura nei cliché da libro di testo.
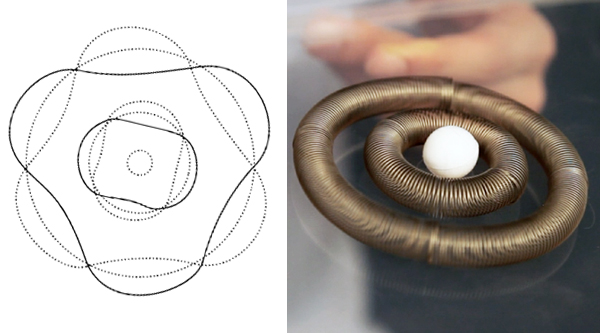
Il giapponese Nagaoka propose nel 1904 un ritratto in cui la carica positiva era concentrata al centro dell'atomo, e sistemi di anelli di elettroni facevano somigliare l'atomo al pianeta Saturno.

1911 Rutherford e l'atomo nucleare.
Il modello di atomo Saturniano venne abbandonato per considerazioni teoriche sulla mancanza di stabilità degli anelli di elettroni. Tuttavia ricevette un'inaspettata conferma sperimentale, dal neozelandese Rutherford coi suoi collaboratori.
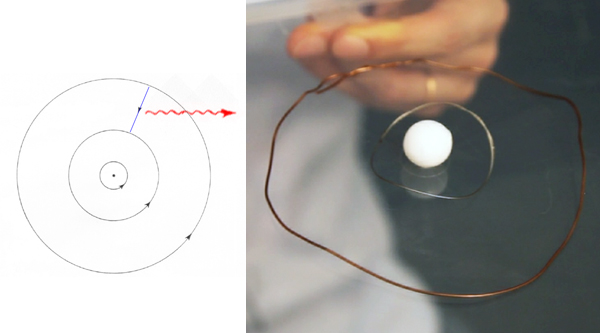
Geiger e Marsden hanno osservato il fatto sorprendente che circa una su ottomila particelle alpha che incidono sulla foglia d'oro sono talmente deviate che emergono di nuovo dal lato dell'incidenza. Tale risultato mette in luce l'enorme intensità del campo elettrico intorno o dentro l'atomo.
Rutherford dedusse inequivocabilmente da questo esperimento che la carica positiva e la gran massa dell'atomo fossero concentrate in un piccolo nucleo al centro. Rutherford lasciava aperte le questioni della stabilità e della struttura minuta del resto dell'atomo.

1913 L'atomo di Bohr
Il danese Bohr propose il suo modello di atomo. Esso rendeva bene conto delle righe spettrali degli atomi idrogenoidi, e spiegava la stabilità applicando all'atomo la teoria dei quanti. Questa teoria era stata introdotta da Planck (1900), e prevedeva che lo scambio di energia tra materia e radiazione luminosa fosse discreto, quantizzato. Einstein (1905) aveva esteso la teoria alla luce, la luce è fatta di quanti di luce, i fotoni.
Bohr estendeva ancora la teoria all'atomo, imponendo che le orbite degli elettroni fossero quantizzate, cioè solo con alcuni livelli di energia ben definiti. C'era un livello di energia fondamentale sotto il quale non si poteva scendere. L'elettrone poteva saltare da un livello d'energia all'altro emettendo o assorbendo fotoni di luce.
Un aspetto fondamentale del modello di atomo di Bohr è che esso dava un significato nuovo al numero atomico. Ciò che nella Tavola di Mendeleev era solo un numero, il numero d'ordine nella tavola (Idrogeno 1, Elio 2, Litio 3...) diventò il numero atomico, il numero di cariche positive e negative dell'atomo. L'Idrogeno ha 1 protone e 1 elettrone, eccetera.
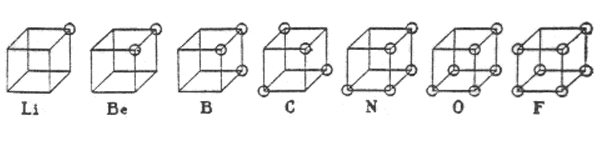
1916 L'atomo cubico di Lewis
Il chimico americano Gilbert Newton Lewis propose un modello di atomo concepito per rendere conto del legame chimico in base agli elettroni di un atomo.
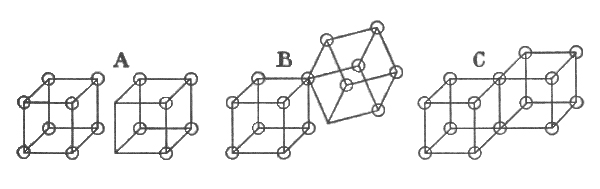
L'atomo diventava “L'atomo cubico”, e nella figura i cerchi rappresentano gli elettroni nel guscio esterno dell'atomo. La configurazione tetraedrica dell'atomo di carbonio viene spiegata col passaggio degli elettroni dai vertici a coppie di elettroni sugli spigoli. Ed è con una coppia di elettroni che viene spiegato il legame chimico.
Lewis introduce anche le formule che prenderanno il suo nome: “Per esprimere questa idea di unione chimica in simboli suggerirei l'uso di due punti che agiscono come i legami di connessione tra i due atomi...”
1924 Le onde di De Broglie e la meccanica quantistica
Il francese Louis De Broglie propose nella sua tesi di dottorato (1924) che anche i quanti di materia (gli elettroni, i protoni eccetera) fossero caratterizzati dalla dualità onda-corpuscolo come i quanti di luce. Con questa ipotesi egli poteva rendere conto delle orbite quantizzate degli atomi: le orbite corrispondevano a onde stazionare di una certa lunghezza d'onda ed energia.
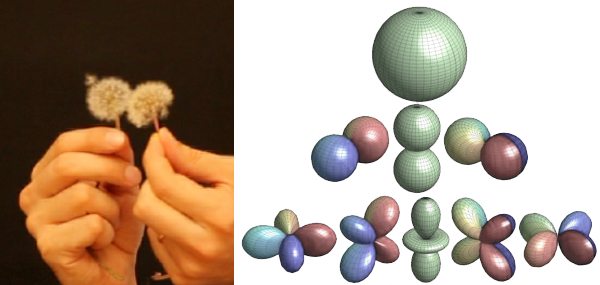
Su questa ipotesi si sarebbe poi sviluppata la meccanica quantistica, che fornì infine il ritratto rigoroso degli atomi. L'elettrone non si può descrivere con una traiettoria, così come le onde non si possono descrivere con una traiettoria. L'elettrone è descritto con una funzione d'onda, che è una sorta di distribuzione nello spazio.
Un elettrone intorno ad un nucleo viene così ad assomigliare ad un soffione. Il centro del fiore rappresenta il nucleo, la nuvola rappresenta l'elettrone. Negli atomi con molti elettroni ci sono diverse “nuvole” concentriche. Queste nuvole sono dette orbitali, e assumono varie forme secondo le funzioni matematiche dette “armoniche sferiche”.